CULTIVO DE CÉLULAS DE INSECTO SF9
- El cultivo de células de insecto se originó como un enfoque para comprender mejor la biología de los insectos. Muchos de los primeros estudios con células de insectos fueron diseñados para analizar cuestiones biológicas básicas. Estos experimentos proporcionaron información valiosa sobre el desarrollo y la patología de los insectos. Además, se ha utilizado el cultivo de células de insectos para desarrollar nuevos insecticidas y otros elementos disuasivos contra las plagas agrícolas.
- Antes de comenzar el procedimiento debemos desinfectar la cabina de flujo laminar con lejía diluida al 10% y etanol 70% con la ayuda de una servilleta. Después introducimos en la cabina los materiales que serán utilizados durante la práctica. Finalmente debemos encender la luz UV durante 5-10 minutos para esterilizarla.
Nota: Todos los materiales que entran en contacto con las células deben ser desinfectados antes de su eliminación, incluyendo placas y frascos de cultivo, pipetas, pipetas de transferencia y tubos.
MATERIALES Y REACTIVOS DEL KIT
A.Células de insecto (Sf9). Tª ambienteB. Medio de cultivo de las células de insecto. Nevera (4ºC)
C. Medio para la práctica de técnica estéril. Nevera (4ºC)
D. Colorante azul tripán. Tª ambiente
E. Tampón Fosfato Salino (PBS1x). Tª ambiente
F. Colorante Giemsa. Tª ambiente
Frasco cultivo celular (estéril, 25 cm2) (T-25). Tª ambiente
Placas de cultivo celular (estéril, 60 mm).
Cámaras de recuento celular.
Pipetas grandes de transferencia (estériles).
Pipetas pequeñas de transferencia.
Pipetas de 10 y 25 ml (estériles).
Tubos de fondo cónico de 15 ml.
Tubos de fondo cónico de 50 ml.
Tubo de centrifuga de 1,5 m
MATERIAL NECESARIO NO INCLUIDO EN EL KIT
 |
| Contenedor de residuos (vaso de precipitado) |
 |
| Alcohol 70% |
 |
| Rotulador |
 |
| Cámara de incubación |
 |
| Metanol |
 |
| Microscopio invertido |
 |
| Auxiliar de pipeteo |
 |
| Auxiliar de pipeteo |
 |
| Bata |
 |
| Guantes |
 |
| Puntas desechables para micropipeta |
A. INICIO DEL CULTIVO DE LAS CÉLULAS DE INSECTO
- Se han desarrollado muchas herramientas y técnicas para mantener células cultivadas. Por ejemplo, los investigadores utilizan frascos estériles y placas que han sido tratadas para permitir que las células adherentes se adhieran y crezcan.
- Las cabinas de flujo laminar ayudan a prevenir la contaminación de las células por bacterias, hongos, levaduras y moho. Las condiciones estériles se mantienen descontaminando todas las superficies y equipos con etanol, y usando pipetas "de barrera" que contienen un filtro.
Preparación de la cabina de bioseguridad
1. Desenchufar la campana.2. Pulverizar lejía diluida al 10%.
3. Pasamos un paño o bayeta por todas las partes de la cabina.
4. Pulverizar con etanol 70% la cabina.
5. Volvemos a pasar un paño o bayeta por las partes de la cabina.
6. Introducir los materiales que vayamos a utilizar en la cabina.
7. Encender la luz ultravioleta durante 5 minutos.
8. Una vez terminado el proceso, apagamos la luz UV y encendemos los filtros.
Nota: Si cuando estemos utilizando la cabina necesitamos introducir nuevo material, los compañeros lo pulverizan con alcohol 70% y nos ayudan a introducirlo en la cabina para evitar la contaminación.
 |
| Cabina de bioseguridad |
Preparación de las Cámaras de Incubación
- Las incubadoras de cultivos celulares especializadas son ampliamente utilizadas en microbiología y biología celular para cultivar bacterias y células eucarióticas. Las incubadoras mantienen el control de temperatura, humedad y otras condiciones tales como el dióxido de carbono y el contenido de oxígeno de la atmósfera interior. Las incubadoras deben mantenerse entre 24-27°C y la atmósfera estándar.
- Se recomienda que las cámaras incubadoras se esterilicen limpiándolas con etanol 70% antes de iniciar el experimento.
 |
| Cámara de incubación |
ALICUOTAR EL MEDIO DE CULTIVO DE LAS CÉLULAS DE INSECTO
- Alicuotar asépticamente 15 ml de Medio de cultivo para células (B) en seis tubos cónicos de 50 ml. Reservar el medio restante.
- Etiquetar cada tubo como Medio de cultivo de las células de insecto.
- Almacenar en la nevera.
CULTIVO DE LAS CÉLULAS DE INSECTO
- Calentar a temperatura ambiente el medio de cultivo.
- Invertir suavemente el tubo de las células para mezclar el contenido.
- Utilizando una pipeta de transferencia estéril, transferir todo el volumen de células de insecto Sf9 a un frasco de cultivo celular estéril.
- Utilizando una pipeta de transferencia nueva, añadimos 2 ml de medio de cultivo de células de insecto fresco al frasco.
- Incubar el frasco de cultivo celular en la cámara de incubación.
- Después de 24 horas, las células de insecto deberían haberse adherido a la superficie del frasco.
- Las células crecerán durante los próximos tres días y las debemos observar diariamente. Deben tener al menos 80% de confluencia antes de pasar al siguiente paso.
- Utilizando una pipeta desechable y una prepipeta, añadimos 4 ml de medio de cultivo de células de insectos a seis frascos T25.
- Golpear suavemente el lado del frasco y pipetear con cuidado arriba y abajo con una pipeta estéril de 10 ml. Añadir 1 ml de células a cada frasco preparado.
- Colocar los frascos en las incubadoras.
B. Módulo 1. APRENDIZAJE DE LA TÉCNICA ASÉPTICA BÁSICA
- Alicuotar asépticamente 5 ml de Medio para la práctica de la Técnica Estéril C en seis tubos de 15 ml utilizando una pipeta estéril de 10 ml.
- Cada grupo debe transferir 3 ml de medio de la práctica de técnica estéril a una placa de cultivo celular de 35 mm.
- Cubrir la placa y colocarla en la cámara incubadora durante una noche.
- Al día siguiente, recuperar la placa de la incubadora y examinarla con un microscopio para comprobar que no hay contaminación.
Nota: Los pasos 2, 3 y 4 se realizaron posteriormente por indicaciones del profesor, aunque lo correcto es realizarlos en el módulo 1.
C. Módulo 2. EXAMEN DE LOS CULTIVOS DE LAS CÉLULAS DE INSECTOS
Preparar microscopios para el análisis de células de insectos.- Recuperar el T-flask con células de la incubadora.
- Examinar las células bajo un microscopio.
- Anotar las observaciones sobre el cultivo celular incluyendo dibujos.
- Volver a colocar el T-flask en la incubadora.
D. Módulo 3. MANTENIMIENTO DEL CULTIVO DE LAS CÉLULAS DE INSECTOS
Parte 1
- Sacar de la nevera las alícuotas del medio de cultivo de las células de insecto.
- Retirar 4 ml del medio del frasco con las células de cultivo utilizando una pipeta de transferencia estéril.
- Desechar el medio retirado del frasco.
- Añadir 4 ml de medio para células de insecto fresco usando una pipeta de transferencia estéril nueva.
- Volver a depositar el frasco con las células de insecto en la incubadora revisándolo diariamente.
Parte 2
- Golpear suavemente la parte inferior del frasco contra la palma de la mano.
- Usando una pipeta estéril de 10 ml y una prepipeta, pipetear la suspensión celular hacia arriba y hacia abajo varias veces.
- Confirmar utilizando un microscopio el desprendimiento de las células de insecto de la parte inferior del frasco.
- Coger dos placas de cultivo celular de 35 mm y etiquetar con la identificación del grupo. Etiquetar una placa “Módulo IV” y otra “Módulo V”.
- Añadir 1 ml de Medio para las células de insecto en cada placa.
- Transferir 1 ml de la suspesión de células de insecto en cada placa de 35 mm.
- Distrubuir las células uniformemente mediante movimientos hacia delante y hacia atrás.
- Examinar las células bajo el microscopio para confirmar que tiene células en sus placas.
- Anotar registro.
- Después de 24 horas, confimar la fijación de las células bajo el microscopio.
Nota: Durante este módulo (3) realizamos los pasos 2,3 y 4 del módulo 1 (transferir 3 ml del medio de cultivo estéril).
E. Módulo 4. ENSAYOS DE VIABILIDAD DE LAS CÉLULAS UTILIZANDO COLORANTE AZUL TRIPÁN
Parte 1
- Alicuotar en tubos de 250 μl de Azul Tripán (D) para todos los grupos.
Parte 2
- Recuperar la placa de cultivo celular “Módulo IV” de la incubadora.
- Pipetear las células arriba y abajo.
- Transferir 10 μl de suspensión celular con la ayuda de una micropipeta en un microtubo. Volver a depositar la placa de células en la incubadora.
- Añadir 10 μl de colorante azul tripán a las células del microtubo y mezclar suavemente golpeando el microtubo.
- Transferir lentamente 20 μl de suspensión de células teñidas de azul
tripán a una muesca en el lado inferior izquierdo de un área de recuento
de la cámara Neubauer.
- Examinar la cámara de recuento en el microscopio usando el objetivo más bajo.
- Mueva el portaobjetos hasta que el campo que se vea sea la rejilla externa.
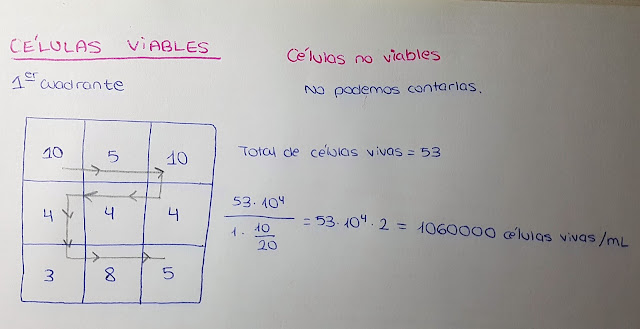
- Contamos las células vivas dentro de cada una de las cuadrículas pequeñas.
Nota: Las muertas no podemos contarlas ya que se observan manchas de colorante.
F. Módulo 5. ENSAYO DE TINCIÓN DIFERENCIAL CON COLORANTE GIEMSA
Parte 1
- Alicuotar 10 ml de PBS (F) en tubos de 15 ml y 1 ml de Colorante Giemsa (G) en tubos de 1,5 ml para los grupos.
- Preparar metanol enfriado poniendo recipientes pequeños de metanol 100% en un congelador a -20ºC al menos 1 hora antes del período de laboratorio.
Parte 2
- Recuperar la placa de células “Módulo V” de la incubadora.
- Desechar el medio de cultivo de la placa.
- Añadir 2 ml de PBS y mueva suavemente la placa.
- Desechar el PBS de la placa.
- Añadir 2 ml de metanol enfriado a la placa y mueva suavemente la placa.
- Tapar la placa e incubar las células durante 10 minutos a temperatura ambiente.
- Desechar el metanol.
- Secar las células, quitando la tapa de la placa, durante 5 min en la mesa del laboratorio.
- Añadir 1 ml de colorante Giemsa en la placa y mover suavemente.
- Incubar la placa durante 30 segundos y desechar el colorante Giemsa.
- Añadir 2 ml de PBS a la placa e incubar durante 5 minutos.
- Desechar el PBS de la placa.
- Lavar la placa dos veces con 2 ml de agua del grifo. Desechar el agua y transferir la placa a un microscopio.
- Examinar utilizando un microscopio de campo brillante la morfología de las células.
Nota: Tras finalizar cada módulo, es muy importante llevar a cabo la adecuada limpieza de todos los materiales utilizados y desecharlos correctamente.
ACTIVIDADES
- ¿Por qué el cultivo de células se ha convertido en una herramienta tan importante para los investigadores?
- El cultivo celular ha dado lugar a importantes avances en los campos de la ciencia de la vida, la biotecnología y la investigación farmacéutica. Por ejemplo, la investigación inicial de vacunas dependió en gran medida del uso de animales para pruebas y producción de virus. Sin embargo, el desarrollo de cepas de cultivo celular ha permitido la transición fuera de animales vivos. El cultivo celular también se usa para estudiar muchas enfermedades comunes, incluyendo trastornos genéticos, infecciones virales y bacterianas y cáncer.
- ¿Cuáles son las ventajas y aplicaciones del cultivo de células de insectos?
- Proporcionan información valiosa sobre el desarrollo y la patología de los insectos. Además, se ha utilizado el cultivo de células de insectos para desarrollar nuevos insecticidas y otros elementos disuasivos contra las plagas agrícolas.
- ¿Por qué se recomienda subcultivar las células al alcanzar una confluencia de 70-80%?
- Las células deben subcultivarse al alcanzar una confluencia de 70-80% porque si esperamos más tiempo, llegarán a alcanzar un 100% de confluencia, comenzando una etapa en la que las células establecen contactos entre ellas que inhiben su proliferación y el crecimiento se detiene.
- ¿Cuál es la razón para dejar una pequeña cantidad de medio de cultivo viejo en el frasco al alimentar o dividir las células?
- Debemos dejar una pequeña cantidad de medio de cultivo viejo para que posibles sustancias beneficiosas para el cultivo producidas y secretadas por las células se mantengan en él.
- Describir los síntomas comunes de la contaminación bacteriana.
- La contaminación bacteriana produce principalmente una disminución del pH y, a su vez, el medio de cultivo se vuelve turbio.
- ¿Por qué sería importante determinar el tiempo de duplicación de una línea celular? ¿Qué información indica el tiempo de duplicación de las células?
- El tiempo de duplicación de las células nos indica a que velocidad se duplican las células. Determinar el tiempo de duplicación de una línea celular es muy importante para conocer aproximadamente en qué momento debemos subcultivar el cultivo antes de alcanzar un 100% de confluencia.






























Comentarios
Publicar un comentario